(14分)CO2和H2可用于合成甲醇和甲醚。
(1)已知①CH3OH(l)+ O2(g) ="=" CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
O2(g) ="=" CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
②H2(g)+ O2(g) ="=" H2O(g) ΔH =-241.8 kJ·mol-1
O2(g) ="=" H2O(g) ΔH =-241.8 kJ·mol-1
③H2O(g) ="=" H2O(l) ΔH =-44 kJ·mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l),同时生成H2O(l)的热化学方程式为_______。
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
已知在投料比n(CO2):n(H2)=1:3的条件下,不同温度、不同压强时,CO2的转化率见下表:
①下列关于上述可逆反应的说法正确的是
| A.在恒温、恒容的密闭容器中,当反应混合气体的密度保持不变时反应达平衡状态 |
| B.当v正(CO2)=" 3" v逆(H2),反应达平衡状态 |
| C.当n(CO2):n(H2)=1:3时,反应达平衡状态 |
| D.a > 60% |
②上述反应的化学平衡常数的表达式为__________。
③该反应的ΔH 0,原因是 。
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应达平衡状态时H2的转化率为 ,混合气体中CO2的体积分数为 。
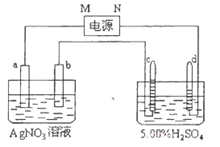
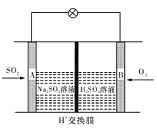
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池:放电时,负极的电极反应式为 。
 )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。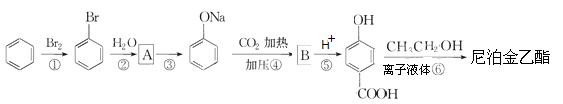



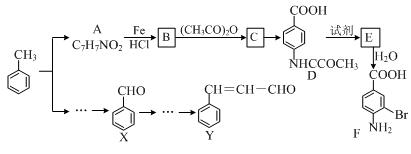



 CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO CH3CH=CHCHO
CH3CH=CHCHO CH3COOH
CH3COOH CH3COOCH2CH3
CH3COOCH2CH3 粤公网安备 44130202000953号
粤公网安备 44130202000953号