光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g)ΔH="+108" kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g)ΔH="+108" kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
①计算反应在第8 min时的平衡常数K= ;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比较产物CO在2 min~3 min、5 min~6 min和12 min~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 ;
⑤比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6) v(15~16)(填“<”、“>”或“=”),原因是 。
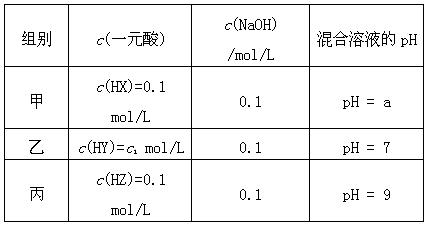
(2)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断 (NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a、NH4HCO3 b、NH4A c、(NH4)2CO3 d、NH4Cl
 的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两
的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两 种氧化物。
种氧化物。 ,用电子式表示其气态氢
,用电子式表示其气态氢 化物。
化物。 。
。
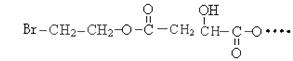
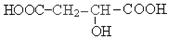

 粤公网安备 44130202000953号
粤公网安备 44130202000953号