草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
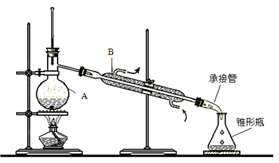
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是: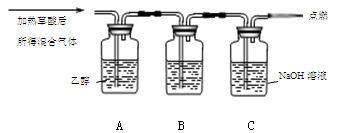
①B中盛装的试剂 (填化学式);
②A中加入乙醇的目的是 。
(二)探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I.实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:□MnO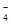 +□H2C2O4+□ =□Mn2++□CO2↑+□H2O
+□H2C2O4+□ =□Mn2++□CO2↑+□H2O
①配平上述离子方程式;
②滴定时KMnO4溶液应盛装于 (填“酸式”或“碱式”)滴定管中。
Ⅱ.探究影响化学反应速率的因素
| 实验编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度 |
||
| 浓度(mol/L) |
体积(mL) |
浓度(mol/L) |
体积 (mL) |
||
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)探究温度对化学反应速率影响的实验编号是 (填编号,下同),探究反应物浓度对化学反应速率影响的实验编号是 。
(2)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。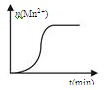
请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因: _____。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号