某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图,发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O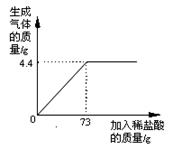
(1)生成CO2的质量为 g。
(2)计算该样品中含碳酸钠的质量分数是多少?(计算结果保留一位小数)
某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图,发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O
(1)生成CO2的质量为 g。
(2)计算该样品中含碳酸钠的质量分数是多少?(计算结果保留一位小数)