同学们做甲、乙两个中和反应实验的探究,如图所示: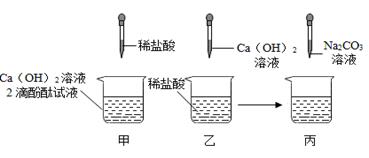
(1)甲实验恰好中和,则该溶液中的溶质是_____ (填化学式)。
(2)取乙反应后的溶液60.0g,滴加质量分数26.5%的Na2CO3溶液,如图丙,溶液pH的变化如图丁,则与CaCl2反应的碳酸钠溶液的质量为_____g;请计算该溶液中CaCl2的溶质质量分数(写出计算过程,精确到0.1%)。
(3)根据计算所得数据在图戊中画出产生沉淀的曲线。
同学们做甲、乙两个中和反应实验的探究,如图所示:
(1)甲实验恰好中和,则该溶液中的溶质是_____ (填化学式)。
(2)取乙反应后的溶液60.0g,滴加质量分数26.5%的Na2CO3溶液,如图丙,溶液pH的变化如图丁,则与CaCl2反应的碳酸钠溶液的质量为_____g;请计算该溶液中CaCl2的溶质质量分数(写出计算过程,精确到0.1%)。
(3)根据计算所得数据在图戊中画出产生沉淀的曲线。