(17分)I.将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:
N2O4(g)  2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示: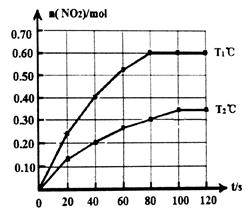
(1)Tl℃时,40s~80s内用N2O4表示该反应的平均反应速率为_________________mol/(L·s)。
(2)△H___________O(填“>”、“<”或“=”)。
(3)改变条件重新达到平衡时,要使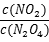 的比值变小,可采取的措施有__________(填序号)。
的比值变小,可采取的措施有__________(填序号)。
a.增大N2O4的起始浓度 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
II.已知:常温下,HCN的电离常数为Ka=5×10-10。
(4)有浓度相同的HCN和NaCN的混合溶液。
①通过计算说明该溶液的酸碱性_____________________________________________。
②该溶液中各离子的浓度由大到小的顺序是___________________________________。
(5)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性。
①该过程溶液中水的电离程度的变化为______________。
②若混合溶液中c(Na+)="a" mol/L,则c(HCN)=_________mol/L。
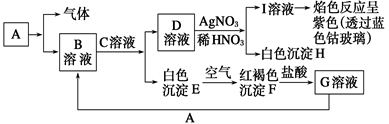
 写出由E转变成F的现象;其发生反应的化学方程式________。
写出由E转变成F的现象;其发生反应的化学方程式________。 体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示。试推断:
体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示。试推断: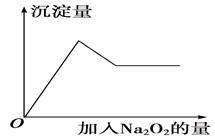
 。
。 _。
_。 、B、C、D是四种可溶性化合物,分别由阳离子K+、Ba2+.、Al3+、 Fe3+和阴离子OH—、CO
、B、C、D是四种可溶性化合物,分别由阳离子K+、Ba2+.、Al3+、 Fe3+和阴离子OH—、CO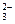 、NO
、NO 、SO
、SO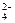 两两组合而成,它们的溶液能发生如下反应:
两两组合而成,它们的溶液能发生如下反应:
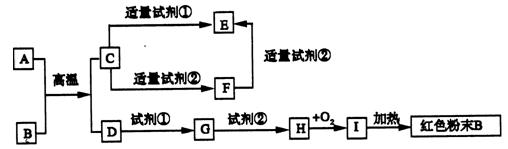
 →F的离子方程式:_____________________________________________
→F的离子方程式:_____________________________________________ 粤公网安备 44130202000953号
粤公网安备 44130202000953号