(17分)工业上煅烧黄铜矿(CuFeS2)冶炼铜并得到碱式硫酸铁[Fe(OH)SO4]等其他重要化合物,主要流程如下(部分反应物和产物未标出):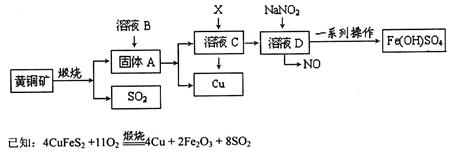
(1)溶液B是_____________________;X是__________________________________。
(2)某同学取溶液C滴入KSCN溶液,溶液不变红,说明溶液C中不含Fe3+,其原因是________(用简单的文字和离子方程式说明):再向该溶液中滴入H2O2溶液,溶液变红色。则滴入H2O2溶液发生反应的离子方程式为___________________。
(3)在溶液D与NaNO2的反应中,常采用同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____________,如参加反应的O2有11.2L(标况),则相当于节约NaNO2物质的量为______________mol。
(4)该法得到的金属铜中常含有金、银、铁、镍等金属杂质,常用电解精炼的方法得到纯铜,请在右边框内画出其原理装置示意图。
(5)[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,它溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________。

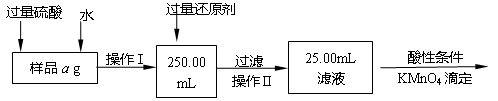

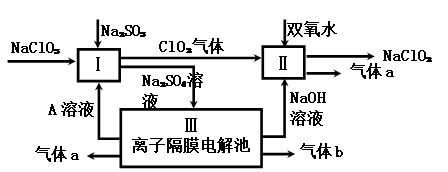
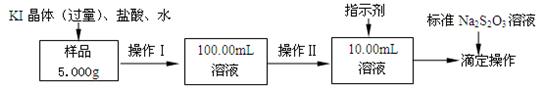
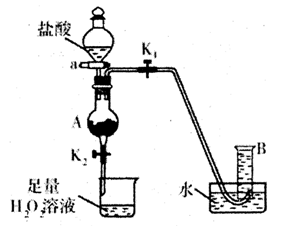
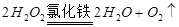 。
。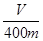 ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是: 。
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是: 。 粤公网安备 44130202000953号
粤公网安备 44130202000953号