为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以存在)转变成重要的化工原料(反应条件略)。

活化硫铁矿还原的主要反应为:,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步与反应的离子方程式是。
(2)检验第Ⅱ步中是否完全还原,应选择(填字母编号)。
A.溶液 B.溶液 C.溶液
(3)第Ⅲ步加调溶液到5.8左右,然后在第Ⅳ步通入空气使溶液降到5.2,此时不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液降低的原因是。
(4)可转化为,在空气中加热反应可制得铁系氧化物材料。
已知25℃,101时:
在空气中加热反应生成的热化学方程式是。
(5)在一定条件下可制得(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为,正极反应式是。
(6)假如烧渣中的铁全部视为,其含量为50%。将质量分数为%的硫酸加入到烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入。
相关知识点
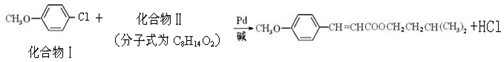
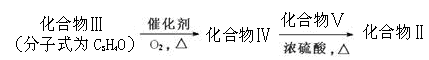
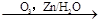 R1-CHO+R2-CHO
R1-CHO+R2-CHO
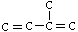 )分子的碳链结构,相对分子质量为152。
)分子的碳链结构,相对分子质量为152。 ’
’ 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。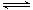 2NO(g) △H
2NO(g) △H 0
0 粤公网安备 44130202000953号
粤公网安备 44130202000953号