毒重石的主要成分(含、、等杂质),实验室利用毒重石制备的流程如下

(1)毒重石用盐酸浸取前需充分研磨,目的是
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
| 开始沉淀时的 | 11.9 |
9.1 |
1.9 |
| 完全沉淀时的 | 13.9 |
11.1 |
3.2 |
加入调节=8可除去
已知:=1.6×10-7,=2.3×10-9
(3)利用简洁酸碱滴定法可测定的含量,实验分两步进行。
已知: ↓
步骤I:移取一定浓度的溶液与锥形瓶中,加入酸碱指示剂,用盐酸标准液滴定至终点,测得滴加盐酸体积为。
步骤II:移取溶液于锥形瓶中,加入与步骤Ⅰ相同浓度的溶液,待完全沉淀后,再加入酸碱指示剂,用盐酸标准液滴定至终点,测得滴加盐酸的体积为。
滴加盐酸标准液时应用酸式滴定管,"0"刻度位于滴定管的


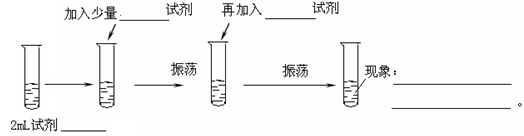
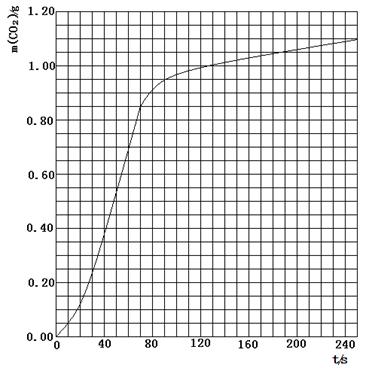
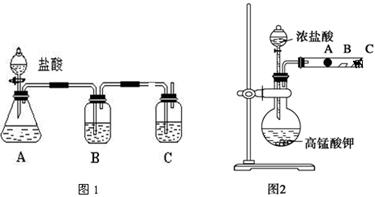
 CaCO3+HNO3
CaCO3+HNO3
 粤公网安备 44130202000953号
粤公网安备 44130202000953号