利用和钴氧化物可制备锂离子电池正极材料。可由电解法制备,钴氧化物可通过处理钴渣获得。
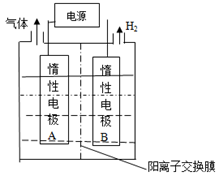
(1)利用如图装置电解制备LiOH,两电极区电解液分别为和溶液。极区电解液为溶液(填化学式),阳极电极反应式为,电解过程中向电极迁移(填"A"或"B")。
(2)利用钴渣[含、等]制备钴氧化物的工艺流程如下:
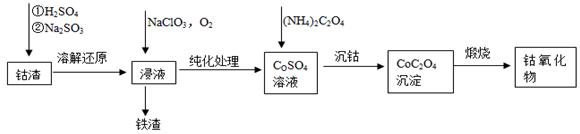
溶解还原反应的离子方程式为,铁渣中铁元素的化合价为,在空气中煅烧生成钴氧化物和,测得充分煅烧后固体质量为,的体积为(标准状况),则钴氧化物的化学式为。
利用和钴氧化物可制备锂离子电池正极材料。可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为和溶液。极区电解液为溶液(填化学式),阳极电极反应式为,电解过程中向电极迁移(填"A"或"B")。

(2)利用钴渣[含、等]制备钴氧化物的工艺流程如下:

溶解还原反应的离子方程式为,铁渣中铁元素的化合价为,在空气中煅烧生成钴氧化物和,测得充分煅烧后固体质量为,的体积为(标准状况),则钴氧化物的化学式为。