(14分)BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如图所示。请回答:
已知:室温时Ksp[Mg(OH)2 ]=1.8×10-11,Ksp[Fe(OH)3 ]=4.0×10-38
(1)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通人空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为_________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓人预热后的空气吹出,预热空气的目的是_________;沉淀A的主要成分是_________。
(3)热空气吹除时会有部分HS-转变为S2O32-,使产品仍不能达到纯度要求,可再行酸化脱硫,酸化脱硫时的离子方程式为_________。
(4)室温时,为使Mg2+、Fe3+完全沉淀(当溶液中离子浓度小于1×l0-5mol 时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
(5)实验室测定产品中x的步骤如下:
①准确称取12.23 g BaCl2·xH2O样品,加入l00 mL稀盐酸加热溶解;
②边搅拌,边逐滴加入0.lmol H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
③将沉淀充分干燥后称量,质量为11.65 g,检验BaSO4沉淀是否洗涤干净的方法是_______;经计算x的数值为_________。
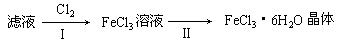
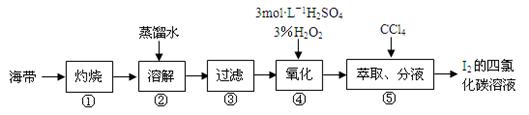
 (1)第①步是将海带放入______________(填仪器名称)中,用酒精灯充分加热灰化。
(1)第①步是将海带放入______________(填仪器名称)中,用酒精灯充分加热灰化。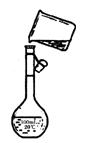
 粤公网安备 44130202000953号
粤公网安备 44130202000953号