我国化学家侯德榜根据NaHCO3的溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl的溶解度都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图。
气体A的饱和溶液 A和食盐的饱和溶液
A和食盐的饱和溶液 悬浊液
悬浊液 晶体
晶体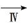 纯碱
纯碱
则下列叙述错误的是
| A.气体A是NH3,气体B是CO2 |
| B.第Ⅲ步得到的晶体是发酵粉的主要成分 |
| C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 |
| D.第Ⅳ步操作主要是溶解、蒸发、结晶 |
我国化学家侯德榜根据NaHCO3的溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl的溶解度都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图。
气体A的饱和溶液 A和食盐的饱和溶液
A和食盐的饱和溶液 悬浊液
悬浊液 晶体
晶体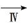 纯碱
纯碱
则下列叙述错误的是
| A.气体A是NH3,气体B是CO2 |
| B.第Ⅲ步得到的晶体是发酵粉的主要成分 |
| C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 |
| D.第Ⅳ步操作主要是溶解、蒸发、结晶 |