(4分)工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下: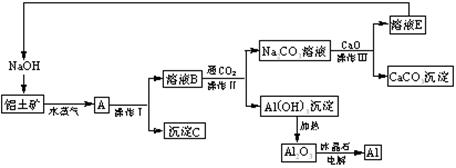
请回答下列问题:
(1)沉淀C的化学式为________。
(2)操作I、操作II、操作III都是_______(填操作名称),实验室要洗涤Al(OH)3沉淀,如何检验该沉淀已洗干净 。
(3)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。
(4分)工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
请回答下列问题:
(1)沉淀C的化学式为________。
(2)操作I、操作II、操作III都是_______(填操作名称),实验室要洗涤Al(OH)3沉淀,如何检验该沉淀已洗干净 。
(3)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。