某实验小组的同学为了探究CuSO4溶液与Na2CO3溶液的反应原理并验证产物,进行如下实验。
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体。该小组同学猜想此固体为xCuCO3·yCu(OH)2。
(1)为了验证猜想,先进行定性实验。
(2)为进一步确定蓝绿色固体的组成,使用如下装置再进行定量实验。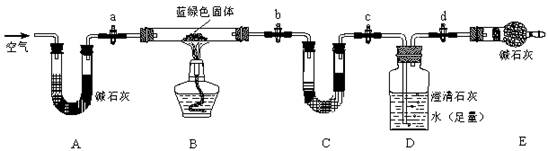
实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中。
①装置C中盛放的试剂是________________,装置E的作用是____________________,反应结束时要通入适量的空气,其作用是____________________________________。
②实验结束后,测得装置C增重0.270g,装置D增重1.320g。则该蓝绿色固体的化学式为____________。
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式______________。
(4)已知20℃时溶解度数据:S[Ca(OH)2] =" 0.16" g,S[Ba(OH)2] =" 3.89" g。有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是_________________________。
(5)有同学为了降低实验误差,提出如下建议,其中合理的是______(填字母序号)。
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置

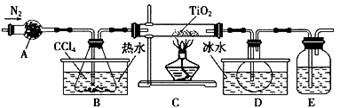
 TiCl4(g)+CO2(g)
TiCl4(g)+CO2(g) Na2S2O3(aq)
Na2S2O3(aq)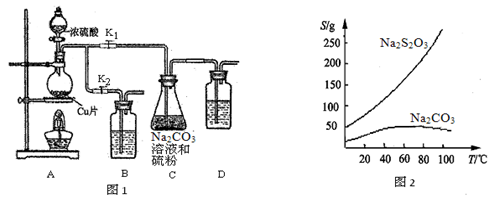

 2[Co(NH3)6]Cl3+14H2O,实验流程如下:
2[Co(NH3)6]Cl3+14H2O,实验流程如下: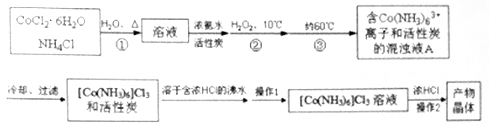
 Co(OH)3↓+6NH3↑+3NaCl(装置见下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水,加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2—3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。已知:
Co(OH)3↓+6NH3↑+3NaCl(装置见下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水,加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2—3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。已知: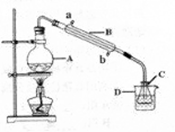
 粤公网安备 44130202000953号
粤公网安备 44130202000953号