在标准状况下,取甲、乙、丙各30.0mL 相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化):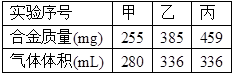
请回答:
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)__________________;乙组实验中盐酸______________。
(2)盐酸的物质的量浓度为_____________。
(3)合金中Mg. Al 的物质的量之比为_______________。
在标准状况下,取甲、乙、丙各30.0mL 相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化):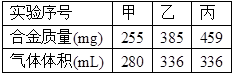
请回答:
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)__________________;乙组实验中盐酸______________。
(2)盐酸的物质的量浓度为_____________。
(3)合金中Mg. Al 的物质的量之比为_______________。