汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致: N2(g)+O2(g) 2NO(g) ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10-3。
2NO(g) ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10-3。
请回答下列问题。
(1)该反应的平衡常数表达式为____________________________________。
(2)该温度下,向2 L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是________%(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应________(填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是_____________________。
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是________。
向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_______(填“变大”、“变小”或“不变”)。
 ;乙中一定含,可能含。
;乙中一定含,可能含。 。
。 Mn(CN)2 + (CN)2↑ + 2H2O
Mn(CN)2 + (CN)2↑ + 2H2O O2(g)=H2O(l) ΔH="-285" kJ·mol-1
O2(g)=H2O(l) ΔH="-285" kJ·mol-1 O2(g)=CO(g) ΔH="-110.5" kJ·mol-1
O2(g)=CO(g) ΔH="-110.5" kJ·mol-1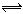 2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则
2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则 =_____________________,各物质所表示的反应速率的最简整数比
=_____________________,各物质所表示的反应速率的最简整数比 :
: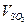 =_________
=_________ 粤公网安备 44130202000953号
粤公网安备 44130202000953号