【化学—物质结构与性质】(12分)
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 ;
②尿素(H2NCONH2)分子中C原子的杂化方式是 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)下列说法正确的是 (填字母序号)。
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低 |
| D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 |
(3)O和Na的一种只含有离子键的化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm(用含ρ、NA的计算式表示)。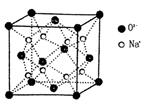

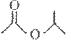 ,请写出它与NaOH溶液反应的化学方程式___________:
,请写出它与NaOH溶液反应的化学方程式___________:
 是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到
是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到
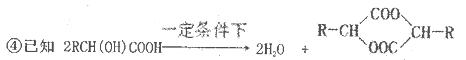
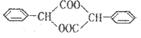 ,起始原料的某烃的结构简式
,起始原料的某烃的结构简式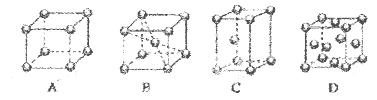
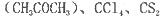 等互溶。
等互溶。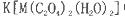 中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。

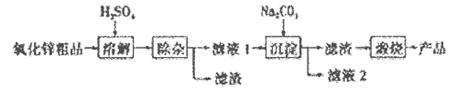

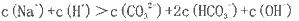
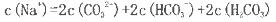
 粤公网安备 44130202000953号
粤公网安备 44130202000953号