(15分)某研究小组从一含锌废渣(质量百分组成:40.5%ZnO 、19.5%CuO、5.7%FeO、7.3% Fe2O3,其余为SiO2)中回收锌和铜,设计以工业废酸(含15%的H2SO4)为酸浸液的方案,其流程如下图(部分条件略):已知碱式碳酸锌的化学式为Zn(OH)2·ZnCO3。
部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
| 离子 |
Fe2+ |
Fe3+ |
Cu2+ |
| 开始沉淀时的pH(初始浓度为1.0 mol/L) |
6.5 |
1.5 |
4.2 |
| 沉淀完全时的pH |
9.7 |
3.2 |
6.7 |
请回答下列问题:
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全).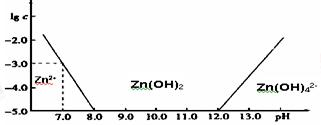
利用图中数据计算,Ksp[Zn(OH)2]= 。
(2)写出试剂a、b的化学式:a: ;b: 。
(3)写出加入H2O2后发生反应的离子反应方程式: 。
(4)写出沉锌过程中的离子反应方程式: ,沉锌后溶液中主要溶质的化学式是 。
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应。写出碱式碳酸锌受热分解的化学方程式 。
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?_______ (填“能”或“否”)
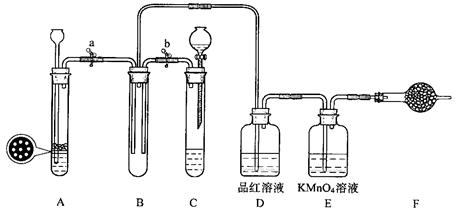
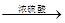 CO2 + CO + H2O,然后用下图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液。试回答下列各题:
CO2 + CO + H2O,然后用下图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液。试回答下列各题:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号