(本题共12分)TiCl4是一种重要的化工原料,其工业生产过程如下:
2FeTiO3(s) + 7Cl2(g) + 6C (s) 2TiCl4 (g)+ 2FeCl3(g) + 6CO(g) – Q (Q>0)
2TiCl4 (g)+ 2FeCl3(g) + 6CO(g) – Q (Q>0)
回答下列问题:该反应达到平衡后,若使正反应速率增大可采取的方法有_________。(选填编号)
a.加压 b.加入碳 c.升温 d.及时移走CO若上述反应在固定体积的密闭容器中发生,一定能说明反应已达平衡的是_______。(选填编号)
a. 反应物不再转化为生成物
b. 炉内FeTiO3与TiCl4的质量比保持不变
c. 反应的热效应不再改变
d. 单位时间内,n(FeTiO3)消耗:n(FeCl3)生成=1:1上述反应中所有非金属元素原子的半径从大到小的顺序为_____________;其中不属于同周期又不属于相邻族的两元素形成_____分子(填“极性”或“非极性”),通过比较____________可以判断这两种元素的非金属性。
上述反应中,非金属性最弱的元素原子的电子共占据_______个原子轨道,最外层电子排布式为____________。它形成的固态单质中只含一种强烈的相互作用力,则该单质属于______晶体。
为方便获得氯气,工业制TiCl4厂可以和氯碱厂进行联合生产。CO可合成甲醇,若不考虑损失,上述联合生产在充分利用各种副产品的前提下,合成192 kg甲醇,至少需补充H2 mol。

 NH3(g) + HI(g) b.2HI(g)
NH3(g) + HI(g) b.2HI(g)  时间(h)物质的量(mol)
时间(h)物质的量(mol)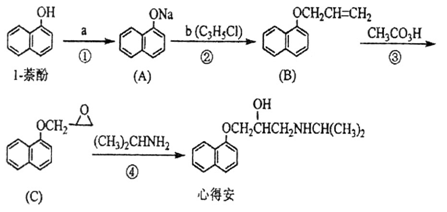

 )_________(填 是或不是)1-萘酚的同分异构体
)_________(填 是或不是)1-萘酚的同分异构体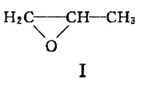

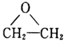 +CH3COOH→
+CH3COOH→ 聚合物
聚合物 可用于制备高吸水性树脂,其单体的结构简式为__________________。以CH3COOH和化合物I为原料可合成该单体,涉及的反应的化学方程式为____________、_____________。
可用于制备高吸水性树脂,其单体的结构简式为__________________。以CH3COOH和化合物I为原料可合成该单体,涉及的反应的化学方程式为____________、_____________。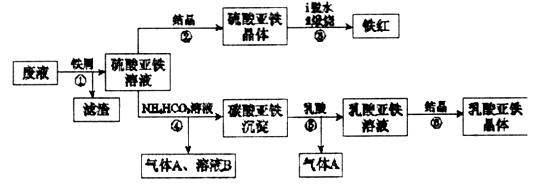
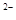 :
: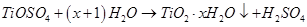
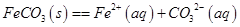 ,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。
,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。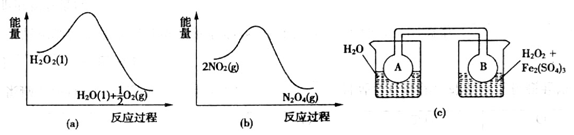
 粤公网安备 44130202000953号
粤公网安备 44130202000953号