蛇文石矿可以看作是由MgO、Fe2O3、Al2O3、SiO2组成。由蛇文石制取碱式碳酸镁的实验步骤如下: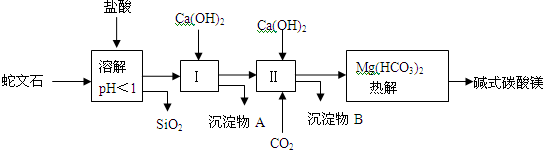
(1)蛇文石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.3 |
9.6 |
Ca(OH)2不能过量,若Ca(OH)2过量会导致 溶解、生成 沉淀。
(3)从沉淀混合物A中提取红色氧化物做颜料,先向沉淀物A中加入 (填物质的化学式),然后 (依次填写实验操作名称)。
(4)物质循环使用可节约能源。上述实验中,可以循环使用的物质是 (填写物质的名称)。
(5)设计一个实验,确定产品a MgCO3·b Mg(OH)2·cH2O中的a、b、c的值。将32.8g产品完全分解后,产生13.2g CO2和16.0g MgO。由此可知,产品的化学式中a∶b∶c= 。(填最简整数比)
 ,
,
 粤公网安备 44130202000953号
粤公网安备 44130202000953号