在盛有40g溶质质量分数为20%氢氧化钠溶液的烧杯中,用滴管吸取盐酸逐滴加入盛有氢氧化钠溶液的烧杯中,验证“中和反应会放热”,同时用pH计记录溶液pH的变化,绘制成如图函数图象。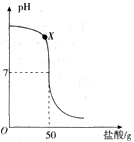
(1)用玻璃棒蘸取X点溶液,在酒精灯火焰上加热至蒸干,玻璃棒上留下的固体中一定含有____(填化学式)。
(2)为什么不能用氢氧化钠固体和稀盐酸反应验证“中和反应会放热”?____。
(3)当pH=7时,求溶液中溶质的质量分数。
在盛有40g溶质质量分数为20%氢氧化钠溶液的烧杯中,用滴管吸取盐酸逐滴加入盛有氢氧化钠溶液的烧杯中,验证“中和反应会放热”,同时用pH计记录溶液pH的变化,绘制成如图函数图象。
(1)用玻璃棒蘸取X点溶液,在酒精灯火焰上加热至蒸干,玻璃棒上留下的固体中一定含有____(填化学式)。
(2)为什么不能用氢氧化钠固体和稀盐酸反应验证“中和反应会放热”?____。
(3)当pH=7时,求溶液中溶质的质量分数。