(10分)CO不仅是家用煤气的主要成分,也是重要的化工原料。工业上用简单有机物合成高分子涂料黏胶剂I的过程如下:
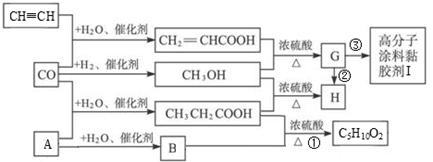
请回答下列问题:
(1)A的结构式 。
(2)G分子中官能团名称是 。
(3)写出反应①的化学方程式 ,指出②的反应类型 。
(4)写出反应③的化学方程式 。
(10分)CO不仅是家用煤气的主要成分,也是重要的化工原料。工业上用简单有机物合成高分子涂料黏胶剂I的过程如下:

请回答下列问题:
(1)A的结构式 。
(2)G分子中官能团名称是 。
(3)写出反应①的化学方程式 ,指出②的反应类型 。
(4)写出反应③的化学方程式 。