氮气是合成氨、合成硝酸等化工生产的重要原料,在生产生活中也有应用广泛。氮气无毒,但如果使用不当,也可能发生意外事故,据报道,5月13日,中石化高桥分公司两员工氮气中毒事件致1死1伤。而氮的氧化物则属于大气污染物。请回答下列氮及其化合物的有关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,请写出N4气体转变为N2反应的热化学方程式:______________________。
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式:________________________。
(3)在T1℃时,将5 mol N2O5置于10 L固定容积的密闭容器中发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①上述平衡体系中O2的体积分数为__________,N2O5的物质的量为__________mol。
②用O2表示从0~5 min内该反应的平均速率υ(O2)= __________。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有__________。
| A.压强 | B.密度 | C.反应速率 | D.N2O5的浓度 |
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为 ___________________ ____________________,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为 g(小数点后保留两位有效数字)。
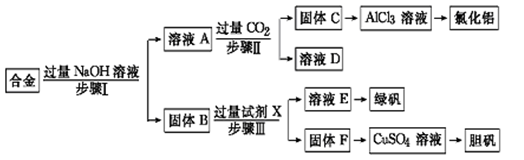




 2CH3CH=CHCOOH+H2O
2CH3CH=CHCOOH+H2O 粤公网安备 44130202000953号
粤公网安备 44130202000953号