某同学为研究电化学原理,使用KC1盐桥设计如图所示实验装置。下列分析合理的是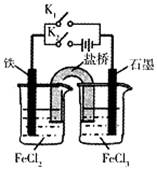
| A.闭合K2断开K1,铁电极上发生的反应为2Cl——2e—=Cl2↑ |
| B.闭合K1,断开K2,盐桥中的氯离子向石墨电极移动 |
| C.闭合K1,断开K2,向右侧烧杯中滴加几滴铁氰化钾溶液,溶液中产生蓝色沉淀 |
| D.无论闭合K1断开K2,还是断开K1闭合K2,铁电极上发生的反应都是Fe—3e—=Fe3+ |
某同学为研究电化学原理,使用KC1盐桥设计如图所示实验装置。下列分析合理的是
| A.闭合K2断开K1,铁电极上发生的反应为2Cl——2e—=Cl2↑ |
| B.闭合K1,断开K2,盐桥中的氯离子向石墨电极移动 |
| C.闭合K1,断开K2,向右侧烧杯中滴加几滴铁氰化钾溶液,溶液中产生蓝色沉淀 |
| D.无论闭合K1断开K2,还是断开K1闭合K2,铁电极上发生的反应都是Fe—3e—=Fe3+ |