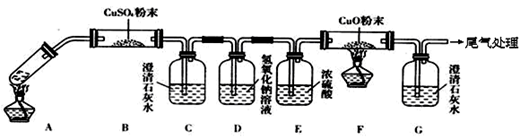
实验室做乙醛和银氨溶液发生银镜反应的实验时:
①为产生光亮的银镜,试管用蒸馏水洗涤后再用_________溶液煮沸,倒掉煮沸液后再用清水将试管冲洗干净。
②配制银氨溶液时向盛有________溶液的试管中逐滴滴加_________溶液边滴边振荡直到_________为止。有关反应的化学方程式:____________________、___________________。
③加热时应用_________加热,产生银镜的化学方程式为________________________________。

 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。 温度(K)
温度(K) CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是____。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是____。

 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 ,则生成沉淀所需CaCl2溶液的最小浓度为。
,则生成沉淀所需CaCl2溶液的最小浓度为。 粤公网安备 44130202000953号
粤公网安备 44130202000953号