[化学——选修3:物质结构与性质]一水硫酸四氨合铜(II)(化学式为 是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
请回答:
(1)沉淀A的晶体中最小环上的原子个数为______,气体C分子中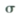 键和
键和 键的个数比为______
键的个数比为______
(2)溶液D的溶质阴离子的空间构型为______,其中心原子的杂化轨道类型为______
(3)MgO的熔点高于CuO的原因为____________
(4)画出一水硫酸四氨合铜(II)中配离子 的配位键____________。
的配位键____________。
(5)湿法炼铜就是利用溶液D制得铜单质,铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示。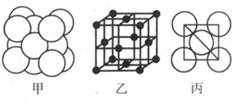
①铜单质晶体中原子的堆积方式为____________,晶胞中Cu原子的配位数为______
②若Cu原子半径为acm,则Cu单质晶体的密度为______g/cm3(只列出计算式,阿伏加德罗常数的值为NA)。







 粤公网安备 44130202000953号
粤公网安备 44130202000953号