草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:
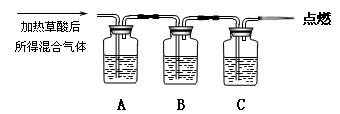
A、乙醇 B、 C、NaOH溶液。
(1)B中盛装的试剂 (填化学式)
(2)A中加入乙醇的目的是 。
(二)探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理: MnO4- + H2C2O4+ = Mn2+ + CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于 (填“酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
| 实验 组别 |
c(H2C2O4) /(mol/L) |
V(H2C2O4) /ml |
c(KMnO4) /(mol/L) |
V(KMnO4) /ml |
c(H2SO4) /(mol/L) |
褪色所需时间 |
实验 目的 |
| 1 |
0.2 |
2 |
0.0025 |
4 |
0.12 |
6'55'' |
(a) |
| 0.2 |
2 |
0.005 |
4 |
0.12 |
5'17'' |
||
| 0.2 |
2 |
0.01 |
4 |
0.12 |
3'20'' |
||
| 0.2 |
2 |
0.02 |
4 |
0.12 |
9'05'' |
||
| 0.2 |
2 |
0.03 |
4 |
0.12 |
11'33'' |
||
| 0.2 |
2 |
0.04 |
4 |
0.12 |
14'20'' |
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是 ;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;
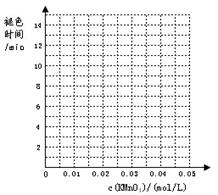
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是 。







 粤公网安备 44130202000953号
粤公网安备 44130202000953号