制备多晶硅(硅单质的一种)的副产物以SiCl4为主,其对环境污染很大,遇水强烈水解,放出大量热量。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,含有钙、铁、镁等离子)制备BaCl2·2H2O,流程为:
已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4和12.4;
(1)①SiCl4水解控制在40℃以下的原因是 。
②已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) ΔH2=189 kJ/mol
则SiCl4被H2还原制备硅的热化学方程式 。
(2)加钡矿粉时生成BaCl2的离子反应方程式 。
(3)过滤②的滤渣A的成分化学式为 ;接着往滤液中加20% NaOH调节pH=12.5,控制温度70℃时,滤渣B的主要成分的化学式 ,控制温度70℃的目的 。
(4)滤液③经 、过滤等操作,再经真空干燥后得到BaCl2·2H2O。
 Q+NaCl
Q+NaCl 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
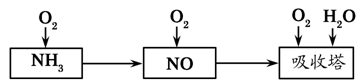
 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。



 B:_______________________________反应类型:________________
B:_______________________________反应类型:________________ 粤公网安备 44130202000953号
粤公网安备 44130202000953号