硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 (该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O实验装置图如下。

(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好。装置D的作用是____________。装置E中为___________溶液。
(2)装置A中发生反应的化学方程式为_______________________。
(3)①装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.酸性高锰酸钾溶液 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②为了使SO2尽可能吸收完全,在不改变C中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
(已知Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↑+SO2↑+H2O;供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)
(5)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
(已知:IO3-+5I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-)

 题:
题:

 TICl4(l) +O2(g)顺利进行的原因是:
TICl4(l) +O2(g)顺利进行的原因是: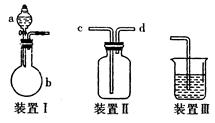


 粤公网安备 44130202000953号
粤公网安备 44130202000953号