甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
反应①:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
(1)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2=-283 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
则反应①的ΔH=________。
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率随反应温度的变化如图所示。
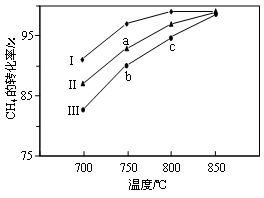
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是________。
②a点所代表的状态________(填“是”或“不是”)平衡状态。
③c点CH4的转化率高于b点,原因是________。
(3)CO和氢气在一定条件下可以合成甲醇,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)。
③在某温度和压强下,将一定量 CO与H2充入密闭容器发生上述反应,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
A.c(H2)减少; B.平衡常数K增大; C.CH3OH 的物质的量增加;
D.正反应速率加快,逆反应速率减慢; E.重新平衡c(H2)/c(CH3OH)减小


 C(g)+D(g),其化学平衡常数K和温度t的关系如下表:回答下列问题:
C(g)+D(g),其化学平衡常数K和温度t的关系如下表:回答下列问题: 粤公网安备 44130202000953号
粤公网安备 44130202000953号