(5分)有以下各组物质,完成以下各组问题:
| A.氧气与臭氧 |
| B.氕与氘 |
C.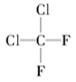 与 与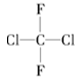 |
| D.乙烯与1—丁烯 |
E.己烷与2,3—二甲基丁烷
以上各组物质属于同位素的是________;属于同素异形体的是________;属于同系物的是________;属于同分异构体的是________;属于同一物质的是________。
(5分)有以下各组物质,完成以下各组问题:
| A.氧气与臭氧 |
| B.氕与氘 |
C. 与 与 |
| D.乙烯与1—丁烯 |
E.己烷与2,3—二甲基丁烷
以上各组物质属于同位素的是________;属于同素异形体的是________;属于同系物的是________;属于同分异构体的是________;属于同一物质的是________。