目前“低碳经济”正成为科学家研究的主要课题。请回答 下列问题
I.甲烷自热重整是一种先进的制氢方法其反应方程式为:CH4(g) + H2O(g) ="CO(g)" + 3H2(g)
(1)阅读下图计算该反应的反应热ΔH = __________kJ/mol。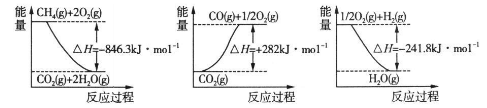
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池则负极的电极反应式为___________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为_____,各离子浓度由大到小的顺序为_______________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s) =5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。
请回答:
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = ____________________。
(6)下列说法不正确的是____________________填字母序号)。
| A.容器内气体密度不变表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |


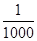 的氰酸盐(含CNO-)。
的氰酸盐(含CNO-)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号