(10分)(1)键线式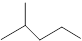 表示的分子式 ;
表示的分子式 ;
名称 。
(2)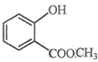 中含有的官能团的名称为 。
中含有的官能团的名称为 。
(3)写出下列物质的结构简式:
2,6-二甲基-4-乙基辛烷: 。
(4)写出该物质的名称: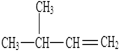 。
。
(10分)(1)键线式 表示的分子式 ;
表示的分子式 ;
名称 。
(2) 中含有的官能团的名称为 。
中含有的官能团的名称为 。
(3)写出下列物质的结构简式:
2,6-二甲基-4-乙基辛烷: 。
(4)写出该物质的名称: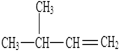 。
。