(11分) I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
| 序号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)根据①组实验情况,分析混合溶液的pH=9的原因是 (用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-)
B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-)
D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c 0.2mol·L-1。混合溶液中离子浓度c(A-) c(Na+)(选填“>”、“<”或“=”)
(3)从③组实验结果分析,说明HA的电离程度 NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是__________________________。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。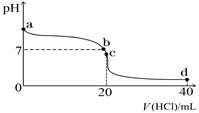
(1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
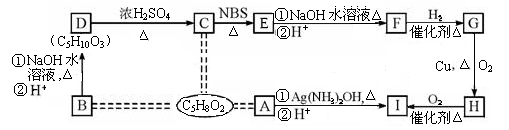

 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。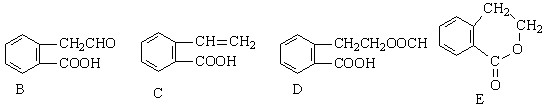
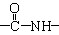 、一个
、一个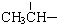 、一个
、一个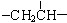 ,还有一个显碱性、一个显酸性的官能团。将该物质在一定条件下水解,能得到两种α—取代羧酸。其中一种的结构简式为:
,还有一个显碱性、一个显酸性的官能团。将该物质在一定条件下水解,能得到两种α—取代羧酸。其中一种的结构简式为: ,另一种水解产物结构简式为:;
,另一种水解产物结构简式为:;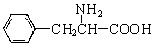 与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(
与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(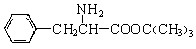 )和CH3OH,则醇X的结构简式为。
)和CH3OH,则醇X的结构简式为。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号