选考(化学-物质结构与性质)
(1)基态铬原子的价电子排布式为 。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为:
K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
上述反应式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
(3)随着人们生活质量的提高,室内的环境安全和食品安全越来越为人们所关注。甲醛(HCHO)是室内主要空气污染物之一(其沸点是–19.5 ℃),甲醇(CH3OH)是“假酒”中的主要有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是 。
(4)双氰胺结构简式如图所示。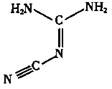
①双氰胺分子中σ键和π键数目之比为 。
②双氰胺分子碳原子的杂化类型为 。
(5)镍元素能形成多种配合物,配离子[Ni(CN)4]2+中不含有的作用力是 (填选项编号)。
| A.离子键 |
| B.配位键 |
C.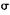 键 键 |
D. 键 键 |
E.氢键
(6)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图所示,则其化学式为 。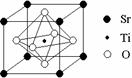

 粤公网安备 44130202000953号
粤公网安备 44130202000953号