把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答: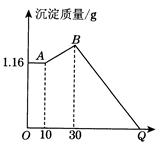
(1)A点的沉淀物的化学式为 ;B点的沉淀物的化学式为 。
(2)原混合物中MgCl2的质量是________g,AlCl3的质量是________g,NaOH的质量是_______g。
(3)Q点HCl溶液加入量是________mL。
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
(1)A点的沉淀物的化学式为 ;B点的沉淀物的化学式为 。
(2)原混合物中MgCl2的质量是________g,AlCl3的质量是________g,NaOH的质量是_______g。
(3)Q点HCl溶液加入量是________mL。