根据下表提供的数据,下列判断正确的是
| 弱酸的化学式 |
CH3COOH |
HClO |
H2CO3 |
| 电离平衡常数 |
1.8×10-5 |
3.0×10-8 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
A.等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-) + c(CH3COO-)
B.常温下,已知酸H2A存在如下平衡:H2A 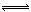 H+ + HA-;HA-
H+ + HA-;HA-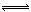 H+ + A2- (Ka15.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
H+ + A2- (Ka15.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C.相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
D.常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5

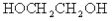
 粤公网安备 44130202000953号
粤公网安备 44130202000953号