已知木炭还原氧化铜实验中发生的主要反应:C+2CuO 2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
探究一:检验产物的成份
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体.暗红色固体是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体;Cu2O+H2SO4═CuSO4+Cu+H2O.
【猜想与假设】暗红色固体除铜外还可能含有Cu2O.
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到现象: ,说明暗红色固体含有Cu2O.
探究二:测定产物中Cu2O的含量
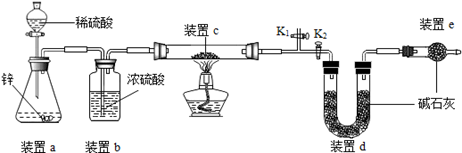
原理:Cu2O+H2 2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是 ;
(2)若不加装置e,实验结果会偏高,原因是 ;
(3)点燃酒精灯前涉及的部分操作如下,正确的顺序是 ;
①打开K2,关闭K1
②检查装置的气密性
③连接仪器
④关闭K2,打开K1,通氢气一段时间
(4)还可通过测定反应前后装置 (填“a”、“b”或“c”)的质量达到实验目的.


 3Fe+4H2O。
3Fe+4H2O。

 CO2↑+CO↑+3H2O。为检验分解后的产物,小赵设计了如图所示实验。回答下列问题。(白色的无水硫酸铜遇水变蓝)
CO2↑+CO↑+3H2O。为检验分解后的产物,小赵设计了如图所示实验。回答下列问题。(白色的无水硫酸铜遇水变蓝)

 粤公网安备 44130202000953号
粤公网安备 44130202000953号