已知A~G七种物质都是初中化学课本中出现过的化合物,其中F是常用的建筑材料;H为常见的单质。各物质之间存在如下转化关系(反应条件如下图所示)。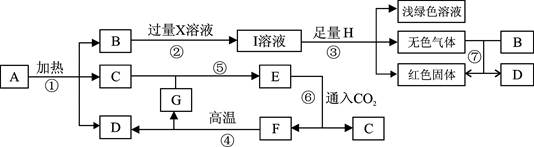
(1)上述I溶液中的溶质有 ;
(2)写出反应①的化学方程式 ;
(3)写出在①~⑦反应中属于复分解的方程式是 ;
写出在①~⑦反应中属于化合反应的方程式是 。
已知A~G七种物质都是初中化学课本中出现过的化合物,其中F是常用的建筑材料;H为常见的单质。各物质之间存在如下转化关系(反应条件如下图所示)。
(1)上述I溶液中的溶质有 ;
(2)写出反应①的化学方程式 ;
(3)写出在①~⑦反应中属于复分解的方程式是 ;
写出在①~⑦反应中属于化合反应的方程式是 。