(1)已知某有机物的结构简式为: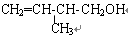 ,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体_______________(用结构简式表示)。
,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体_______________(用结构简式表示)。
(2)已知某高分子化合物的结构简式为: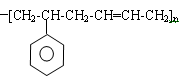 ,写出合成该高分子化合物的单体_______________(用结构简式表示)。
,写出合成该高分子化合物的单体_______________(用结构简式表示)。
(1)已知某有机物的结构简式为: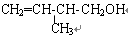 ,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体_______________(用结构简式表示)。
,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体_______________(用结构简式表示)。
(2)已知某高分子化合物的结构简式为: ,写出合成该高分子化合物的单体_______________(用结构简式表示)。
,写出合成该高分子化合物的单体_______________(用结构简式表示)。