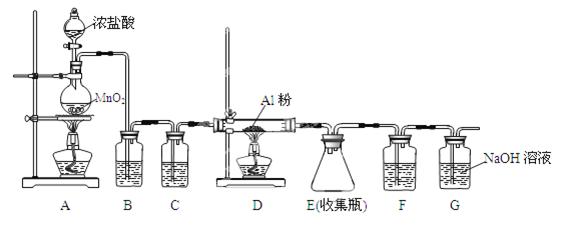
某小组用下图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验)。
实验操作和现象:
| 操作 |
现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 |
i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀。 |
| 用湿润的淀粉碘化钾试纸检验C中白雾 |
淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 |
有白色沉淀生成 |
查阅资料:a.S2O32—有较强的还原性
b.酸性条件下S2O32—迅速分解为S和SO2
(1)A中发生反应的离子方程式是 。
(2)B中饱和NaCl溶液的作用是 。
(3)C中生成黄色沉淀的离子方程式是 。
(4)为检验C中是否有SO2生成,需进行的操作是 。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是 。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是 。




 B.
B. C.
C. D.
D.

 粤公网安备 44130202000953号
粤公网安备 44130202000953号