过氧化钙在常温下是无色或淡黄色粉末,易溶于酸,难溶于水、乙醇等溶剂,常用于种子消毒、药物制造、鱼池增氧等。
I.某实验小组在实验室用钙盐制取CaO2·8H2O(该反应为放热反应)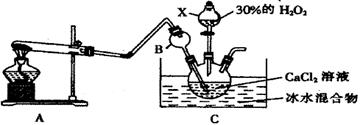
(1)A为实验室制取氨气的装置,则A中试管所装的试剂的名称为 。
(2)仪器B的作用是 。
(3)写出生成CaO2·8H2O的离子方程式 。
(4)制取CaO2·8H2O一般在0~5℃的低温下进行,原因是 。
II.该实验小组欲通过测量气体的体积来探究CaO2与SO2反应的特点。装置如下图:
(硬质玻璃管中为无水CaO2)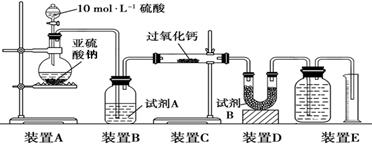
【提出假设】
假设1:反应只发生2SO2+2CaO2=2CaSO3+O2,SO2未被氧化;
假设2:反应只发生SO2+CaO2=CaSO4,SO2完全被氧化;
假设3:上述两个反应均发生,SO2部分被氧化。
【实验探究】
(5)该实验装置有一处明显错误,请改正 。
(6)试剂A为浓硫酸,试剂B的作用是 。
【实验数据处理】实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,
装置E中收集到的气体为V L(已换算成标准状况下)。
(7)在记录量筒中的液面位置时,除视线平视外,还应 。
(8)如果假设3成立,则V的取值范围是 【M(CaO2)=72,M(CaSO3)=120】。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号