偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是 .
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)⇌2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应.
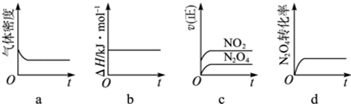
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 .若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)= mol/(L•s)﹣1.
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为 mol•L﹣1。(NH3•H2O的电离平衡常数取Kb=2×10﹣5 mol•L﹣1)
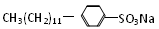 )是常用洗涤剂的主要成分。其结构可用图形“-”“○”来表示,左端为链烃基,右端为极性基。根据这一结构特点,试分析和回答下列问题。
)是常用洗涤剂的主要成分。其结构可用图形“-”“○”来表示,左端为链烃基,右端为极性基。根据这一结构特点,试分析和回答下列问题。
 O2(g) ===H2O(l) △H=" -" 285.8kJ• mol-1
O2(g) ===H2O(l) △H=" -" 285.8kJ• mol-1 粤公网安备 44130202000953号
粤公网安备 44130202000953号