【化学—选修3:物质结构与性质】X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的。Z是同周期元素中离子半径最小的元素。W原子的价电子层上有两个运动状态不同的电子。请回答下列问题: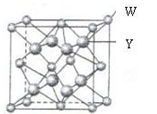
(1)X、Y两种元素的元素符号是: 、 。X、Y可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是: ;中心原子的杂化方式是: 。这种化合物不易作配体形成配离子的原因是 。
(2)X的氢化物易溶于水的原因是: 。
(3)Z的电子排布式是: 。根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Z属于 区。
(4)W与Y形成的化合物的晶胞边长为a pm。晶胞中含有________个W离子、W离子的配位数是 ,晶体的密度是________g·cm-3。(只要求列算式,不必计算出数值,阿伏加德罗常数数值为NA)。
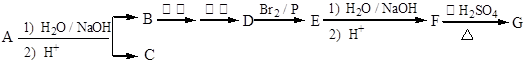
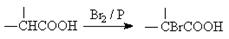
 )结构。
)结构。 

 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。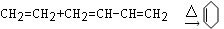
 粤公网安备 44130202000953号
粤公网安备 44130202000953号