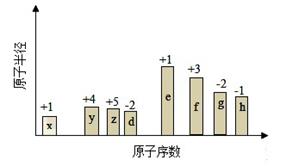
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)甲烷与水蒸气反应,被氧化的元素是 ,当生成标准状况下35.84L合成气时转移电子的物质的量是 。
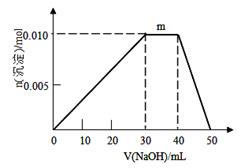
(2)将2 mol CH4和5 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度、压强的关系如图。
①达到A点所需的时间为5min,则v(H2)= ,100℃时平衡常数K= 。
②图中的Pl P2(填“<”、“>”或“=”),A、B、C三点的平衡常数KA、KB、KC的大小关系是 。
(3)合成气用于合成氨气时需除去CO,发生反应CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)  H<0,
H<0,
下列措施中能使 增大的 (选填编号)。
增大的 (选填编号)。
A.降低温度 B.恒温恒容下充入He(g)
C.将H2从体系中分离 D.再通入一定量的水蒸气
可用碳酸钾溶液吸收生成的CO2,常温下pH=10的碳酸钾溶液中水电离的OH-的物质的量浓度为 ,常温下,0.1 mol·L-1KHCO3溶液pH>8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”)。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号