某研究性小组探究乙酸乙酯的反应机理,实验如下:
CH3COOH + C2H5OH 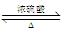 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)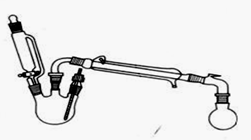
已知:相关物理性质(常温常压)
| |
密度g/mL |
熔点/℃ |
沸点/℃ |
水溶性 |
| 乙醇 |
0.79 |
-114 |
78 |
溶 |
| 乙酸 |
1.049 |
16.2 |
117 |
溶 |
| 乙酸乙酯 |
0.902 |
−84 |
76.5 |
不溶 |
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪
用醋酸羟基氧示踪
含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理 。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K= 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合? 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质? 。
饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净? 。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号