聚酰胺—66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:
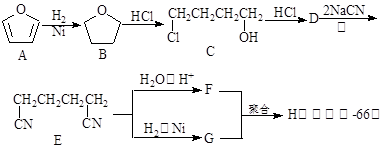
已知反应:
(1)能与银氨溶液反应的B的同分异构体的结构简式为 ,
(2)D的结构简式为 ,①的反应类型为 ,
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及 ,
(4)由F和G生成H的反应方程式为 。
聚酰胺—66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:

已知反应:
(1)能与银氨溶液反应的B的同分异构体的结构简式为 ,
(2)D的结构简式为 ,①的反应类型为 ,
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及 ,
(4)由F和G生成H的反应方程式为 。