A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系。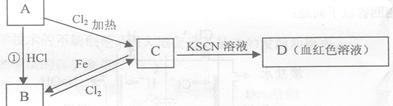
试回答下列问题:
(1)A是_____________。
(2)C是__________。
(3)C的溶液与NaOH溶液混合后产生的现象是___________________________。
(4)反应①的反应类型是___________________。
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系。
试回答下列问题:
(1)A是_____________。
(2)C是__________。
(3)C的溶液与NaOH溶液混合后产生的现象是___________________________。
(4)反应①的反应类型是___________________。