能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
右图是反应I反应过程中的能量变化曲线。
(1)由右图可知反应I为反应(选填”吸热、放热”),反应热△H1=
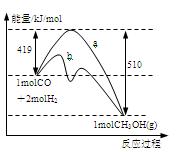
(2)反应I在一定体积的密闭容器中进行,能判断其是否达到化学平衡状态的依据是。
| A.容器中压强不变 |
B.混合气体中c(CO)不变 |
| C.v正(H2)=v逆(CH3OH) |
D.c(CO)=c(CH3OH) |
(3)图中曲线表示使用催化剂时反应的能量变化。
(4)一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数数
K值=(用分数表示),若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡时CH3OH的转化率为,若平衡后在充入4 mol的N2,则C(CO2)是。
(5)从绿色化学的角度比较上述两种方法,符合原子经济的是。(填“I” 或“II”)