(6分)下图是中学化学中常见的一些物质之间的转化关系图,其中部分反应中的产物未列出。已知:A为红色固体,B为无色油状液体,是实验室常见的气体干燥剂, C是无色气体,F为黄绿色气体,G为白色沉淀。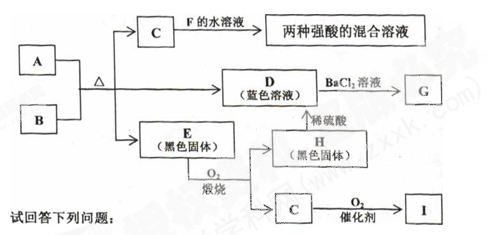
(1)G的化学式为 。
(2)F的电子式为 。
(3)写出H与稀硫酸反应生成D溶液的离子方程式 。
(4)写出无色气体C与O2反应生成I的化学方程式,并用双线桥表示出电子转移的方向和数目: 。
(6分)下图是中学化学中常见的一些物质之间的转化关系图,其中部分反应中的产物未列出。已知:A为红色固体,B为无色油状液体,是实验室常见的气体干燥剂, C是无色气体,F为黄绿色气体,G为白色沉淀。
(1)G的化学式为 。
(2)F的电子式为 。
(3)写出H与稀硫酸反应生成D溶液的离子方程式 。
(4)写出无色气体C与O2反应生成I的化学方程式,并用双线桥表示出电子转移的方向和数目: 。